
- EN
- CH



《已发布化学仿制药参比制剂调整程序》
(征求意见稿)
为规范化学仿制药参比制剂遴选工作,实现参比制剂动态管理,发挥好参比制剂在仿制药研究中的标杆作用,促进仿制药高质量发展,特制定本程序。
一、调整情形符合以下情形之一的,属于本程序调整范围。
(一)经国家药监局审核评估药品安全性、有效性及质量可控性存在风险,注销、撤销批准文号或停止上市销售的药品。
(二)基于科学研究进展,不符合现行《中国药典》要求或现行审评技术要求的药品。
(三)经核实存在提供虚假信息获得参比制剂地位或已发布参比制剂存在质量可控性问题等情况的药品。
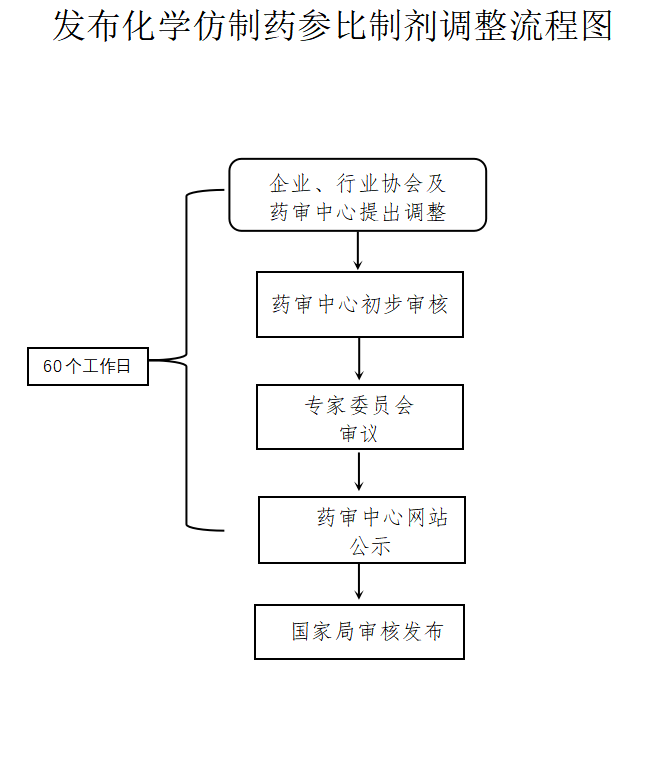
二、调整申请的提出企业、行业协会及药审中心根据以上调整情形,可对国家药监局已发布的参比制剂提出参比制剂调整申请。
三、调整程序
(一)药审中心初步审核药审中心对参比制剂调整申请进行初步审核,形成初步审核意见提交专家委员会审议。
(二)专家审议药审中心组织专家委员会对调整申请进行审议,审议意见分为同意、不同意和再议。专家就审议意见进行投票,审议结果按半数以上的专家意见为准,如审议结果均未超过半数,则按再议处理。
(三)公示和异议处理药审中心在收到申请后60个工作日内对外公示审议结果,公示期为10个工作日。对收到的异议,按照以下方式处理:1.对专家会已充分研究,并有明确审议结论,无新证据的异议意见,维持原审议结论,不再组织进一步审议。2.对经药审中心初步审核,有新证据,需进一步研究的异议意见,药审中心再次组织专家委员会审议,原则上应邀请该品种的利益相关方参加会议。
(四)审核发布经以上程序,公示无异议的审议意见,或经连续两次专家会审议,审议意见一致的,报国家药监局审核发布。
《药物临床试验期间方案变更技术指导原则》
一、概述
药物临床试验期间方案变更是指药物临床试验获准开展并开始实施后,因各种原因,需要对药品审评机构已认可的临床试验方案内容进行修改或完善。
申办者应承担临床试验方案变更的主体责任,全面、深入评估临床试验期间方案变更的必要性和科学合理性,评估方案变更对受试者安全的影响。
为指导申办者更好地开展临床试验期间方案变更的安全性评估及相关工作,降低临床试验风险,保护受试者安全,制定了本指导原则。
本指导原则适用于与注册相关的中药、化药、生物制品以及疫苗相关的临床试验方案变更。本指导原则不适用于改变剂型、给药途径、适应症以及增加与其他药物联合用药。
二、一般情形与评估要点
(一)一般情形
药物临床试验开始实施后,因各种原因,可能出现需要变更临床试验方案中相关内容的情形。主要包括以下几方面:
1.临床试验期间,发现药物新的安全性问题或潜在安全风险,如临床或非临床研究中新的安全性数据与信息等,需要及时对临床试验安全性研究相关内容进行修改或完善;
2.临床试验期间,需要对临床试验有效性研究相关内容进行修改或完善;
3.临床试验期间,为使临床试验实施过程更便捷和高效,需要修改试验方案中相关内容;
4.其他,不涉及试验方案设计的变化,如变更联系人、联系方式等。
(二) 评估要点
药物临床试验期间,在方案变更前,除上述一般考虑因素外,还需全面、深入评估方案变更的必要性和科学合理性。应结合非临床安全性、有效性研究、药学工艺、质量标准、稳定性研究等,以及临床试验的不同阶段和性质,如首次人体试验、探索性试验、确证性试验等,对方案变更后临床试验的整体设计、实施、预期有效性结果、统计分析、风险控制、风险-受益权衡等重新进行全面、深入评估,评估要点包括:
1. 临床试验受试者的安全风险;
2. 临床试验科学性;
3. 临床试验规范性和数据可靠性。
三、变更分类
根据临床试验方案变更对受试者安全风险、试验科学性、规范性以及数据可靠性的影响程度大小,尤其是可能产生不利影响,如增加受试者安全风险、降低临床试验科学性、规范性及试验数据可靠性等,将临床试验期间方案变更分为实质性变更和非实质性变更。
(一)实质性变更
实质性变更是指对临床试验受试者的安全性、试验的科学性和规范性、试验数据的可靠性具有明显影响的变更。
常见实质性变更举例如下:
1. 变更主要目的;
2. 变更主要指标或对试验安全性、科学性有重要影响的次要指标;
3. 变更主要指标、重要次要指标的测定方法;
4. 变更试验药物,指重大或中等的药学工艺变更后可能导致试验药物物质基础的改变;
5. 变更给药剂量;
6. 变更给药方案,如给药时间、间隔时间、给药周期等;
7. 变更、增加或删除对照组/对照药物(包括安慰剂);
8. 变更可能对试验科学性、安全性有重要影响的纳入标准或排除标准,如明显改变受试人群特征等;
9. 减少安全性指标或访视次数或缩短随访时间;
10. 变更可能对试验安全性、科学性有重要影响的诊断、治疗方法或程序;
11. 变更可能对试验安全性、科学性有重要影响的基础治疗;
12. 变更联合用药;
13. 变更试验结束的定义/标准,如暂停试验标准、终止试验标准或停药标准等;
14. 变更主要指标或重要次要指标的统计分析方法;
15. 撤销数据安全监察委员会;
16. 其他。
(二)非实质性变更
非实质性变更是指对临床试验受试者的安全性、试验的科学性、完整性、规范性,试验数据的可靠性不会产生明显影响的变更。
常见非实质性变更举例如下:
1. 文字打印错误;
2. 变更申办方联系人、联系方式等;
3. 变更临床研究机构、研究者、联系方式等;
4. 变更合同研究组织、联系人、联系方式等;
5. 变更样本检测、统计分析、数据管理等相关方、联系人、联系方式等;
6. 变更试验药物或对照药物批号;
7. 受试者总体数量不变,参加机构之间的受试者数量适当调整;
8. 记录试验数据的文件格式或内容的适当调整;
9. 基于预防目的而不是紧急风险控制情况下增加安全性检测指标或访视次数;
10. 增加试验参加机构;
11. 其他。
四、安全风险评估
临床试验方案变更实施前,申办者应先对受试者的安全风险,以及变更试验方案的科学性、规范性等进行全面、深入的研究与评估,科学合理地判断方案变更的性质,区分实质性变更或非实质性变更。
对于实质性变更,需进一步评估是否会增加临床试验受试者的安全风险。
对变更后受试者安全风险的评估,应重点围绕受试人群特征及范围、试验药物给药方案、药物暴露程度、安全剂量范围、非临床安全性研究及已知的临床安全性研究结果对目前安全性研究设计的支持程度等进行深入分析,评估方案变更后临床试验受试者风险是否增大或出现新的风险。在此基础上,结合非临床有效性研究及已知的临床有效性研究结果,进一步评估受试者预期获益-风险。
举例如下:
增加给药剂量或延长给药时间,并且超出了非临床安全性研究结果和/或已知临床安全性研究结果提示的安全窗,将可能导致受试者安全风险明显增加。
删除排除标准中“肝、肾功能异常者”,但非临床安全性研究结果提示本品具有明显的肾毒性,综合评估后认为,变更方案后的临床试验安全风险明显增加;
修订入组标准,将病情程度由“重度”修改为“轻度”,但非临床安全性研究结果和/或已知临床安全性研究结果提示本品有较大毒性反应,变更后预期风险大于获益。
本指导原则中无法列举试验方案变更中安全风险评估的所有情形。申办者应结合具体情况,开展全面深入地分析和研究,科学合理地评估临床试验期间方案变更对于受试者安全风险的影响。
五、伦理审查
对药物临床试验期间方案变更,申办者在开展风险评估后,应严格遵守伦理审查的相关规定和要求,根据伦理委员会的审查意见,进一步加强临床试验期间方案变更的风险控制,切实保护好临床试验受试者安全。
六、沟通交流
对于本指导原则中未涵盖的复杂的或疑难方案变更情形,申办者在开展风险评估的基础上,可按照《药物研发与技术审评沟通交流管理办法》相关规定,向药品审评中心提出相应类别的沟通交流申请。
七、变更程序及资料要求
(一)方案变更实施前,申办者应根据变更的不同性质及对受试者安全风险的影响,按照以下程序开展工作:
1、对可能增加受试者安全风险的实质性变更,应按照《药品注册管理办法》等相关法规要求,提出补充申请;
2、对其他的实质性变更,可按照《药品注册管理办法》等相关法规要求,直接实施;必要时,尤其是对于确证性临床试验,可向药审中心提出沟通交流申请;
3、非实质性变更,可按照《药品注册管理办法》等相关法规要求,直接实施。
(二)方案变更实施后,申办者还需要按照相关要求在药物临床试验登记与信息公示平台更新信息。
(三)方案变更实施后,申办者还应按照相关要求在《研发期间安全性更新报告》(DSUR)中汇总报告。
(四)申办者向药品审评机构提出补充申请或沟通交流申请时,至少应提供以下技术资料:
1.详细说明变更的具体内容。提供变更前、后的临床试验方案及变更事项列表对比;
2.详细说明变更的必要性、科学合理性以及受试者安全风险控制等相关的依据并提供相关研究资料。
3.提供方案变更前、后的知情同意书、研究者手册。
4.提供临床试验综述资料、药理毒理综述资料、药学综述资料。
5. 必要时,还应提供非临床、药学等相关研究资料。